|
Ileitis Monitor |
 |
| Onlinemagazin zur Ileitis des Schweines | ... online seit 2003 | |
|
Unter Verwendung von wissenschaftlichem Material von Dr. Steve McOrist, Dr. Torsten Hardge, Dr. Volker Ohlinger, Prof. Dr. Joachim Pohlenz, Harm Voets DVM, Don Walter DVM. Die Sektion ist ein wichtiger Bestandteil der Diagnose von Infektionen durch Lawsonia intracellularis. Sie dient vor allem auch der Differentialdiagnose bei Erkrankungen durch andere darmpathogene Erreger. Bei Schweinen mit Diarrhoe muss die Sektion spätestens innerhalb von 1 bis 2 Stunden nach Eintritt des Todes durchgeführt werden. Zu einem späteren Zeitpunkt ist eine pathologische Untersuchung nicht mehr sinnvoll, da das Gewebe bereits autolytischen Veränderungen unterliegt. Der Dünndarm liegt im rechten, dorsalen Abdomen und erstreckt sich bis zum ventralen Boden des Abdomens. Der Dickdarm befindet sich im mittleren Abdomen, wobei das stumpfe Ende des Blinddarms oft am Bauchhöhlenboden in der Nähe des Nabels zu liegen kommt. Der Blinddarm erstreckt sich entlang der linken Flanke des Schweines. Die Schlingen des Kolons sind kegelartig zu drei doppelspiralförmigen Windungen im ventralen Mesenterium aufgerollt. Der erste Schritt nach der Eröffnung des Abdomens eines toten Schweines ist die palpatorische Untersuchung der Mesenterialwurzel auf Hinweise für eine Torsion. Darmtorsionen kommen bei Mastschweinen und adulten Schweinen recht häufig vor, sind klinisch relevant und in der Regel tödlich. Zum Teil werden sie auch als "Haemorrhagic bowel syndrome" bezeichnet, eine entzündliche Reaktion ist jedoch nicht beteiligt. Die hochgradig vermehrte Rötung der in die Torsion einbezogenen Darmschlingen ist vielmehr eine Folge der passiven Blutstauung. Bei dem in linker Seitenlage (also rechte Seite nach oben) und mit den Gliedmaßen in Richtung des Untersuchers abgelegten Schwein wird die linke Hand mit dem Handballen nach oben unter den kaudalen Rand der Mesenterialwurzel geschoben, die normalerweise eine flache, glatte Struktur bildet. Besteht eine noch so geringgradige mesenteriale Torsion, so fühlt sich das Mesenterium gespannt und strangartig an. Bei der Palpation ermittelt man die Richtung und das Ausmaß der Torsion (Fotos 5.2. a-b). Zu bedenken ist, dass Torsionen auch post mortem entstehen können, in diesem Fall ist aber keine Stauung oder vermehrte mesenteriale Gefäßzeichnung vorhanden.
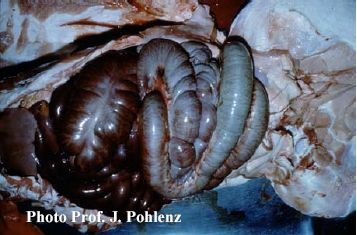
Foto 5.2 a: Situs eines an einer Kolontorsion verendeten Schweines. Verlagerung des Dickdarms mit hochgradiger Blutung in das Darmlumen infolge der venösen Stauung. 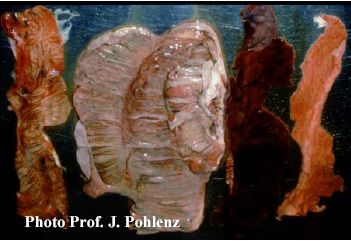
Foto 5.2 b: Gewaschene Dickdarmwand eines Kolons nach Torsion. Blutgerinnsel im Lumen, aber weder entzündliche noch proliferative Reaktionen. Der Darm wird aus der Bauchhöhle herausgenommen, von seinem Mesenterium getrennt und in seiner gesamten Länge auf dem Tisch ausgebreitet. Die Darmwand wird eröffnet und die Schleimhautoberfläche samt Darminhalt sorgfältig untersucht. Aggregierte Lymphknoten (Peyersche Platten) sind auf der gesamten Länge des Dünn- und Dickdarms vorhanden. Diese plattenartigen Strukturen zeichnen sich in der Regel auf der Serosaoberfläche als blasse, umschriebene, leicht erhabene Bereiche auf der der mesenterialen Befestigung gegenüber liegenden Seite ab (Foto 5.2 c).
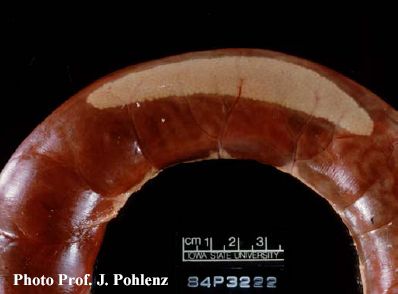
Foto 5.2 c: Peyersche Platte in einer erweiterten, blutgefüllten Dünndarmschlinge 450 cm hinter dem Pylorus. Dieses Mastschwein war infolge eines blutenden Magenulkus verblutet.
Das breite, kontinuierliche Band der Peyerschen Platten im terminalen Abschnitt des Dünndarms kann das kontrahierte
Ileum auch ohne pathologische Veränderung verdickt erscheinen lassen. Die Peyerschen Platten bilden um die ileozäkale
Öffnung eine sicht- und palpierbare Verdickung der Schleimhaut, die oft auch als Dickdarmtonsille bezeichnet wird.
Sie hat einen Durchmesser von in der Regel 2 cm, erstreckt sich gelegentlich dreibeinartig in das Zäkum und das Kolon
hinein und weist eine erhabene, mit Gruben besetzte Oberfläche auf. Histopathologie und Immunhistochemie (IHC): Für die histopathologische/immunhistochemische Untersuchung werden Darmproben in gepufferter Formalinlösung fixiert (Immersionsfixierung) und in ein Medium zur Anfertigung histologischer Schnitte eingebettet.
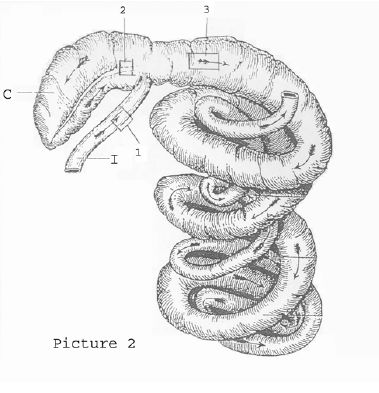
Abbildung 5.2.1 a: Entnahmestellen der Proben für die Histopathologie, Immunhistochemie und PCR. Die Proben für die PCR und die Histopathologie/IHC werden 10 cm proximal der ileozäkalen Öffnung (Nr.1), 5 cm distal der Blinddarmbasis (Nr. 2) und 10 cm distal des Kolonbeginns (Nr. 3) entnommen. Histopathologische Proben werden in ein Gefäß mit Formaldehyd gegeben, wobei jede Beschädigung der sehr sensiblen Schleimhautoberfläche zu vermeiden ist. Die Gewebeproben für die PCR werden in drei getrennte Plastikgefäße gegeben, und sofort in Eis gekühlt. Alle Gefäße müssen mit wasserfestem Stift beschriftet werden, damit die Nummer des Tieres und die Lokalisation der Gewebeprobe später eindeutig nachvollziehbar sind. Histopathologisch unterscheiden sich die verschiedenen Erkrankungsformen der Lawsonia intracellularis-Infektion in einigen Merkmalen, die Grundzüge der Veränderungen sind jedoch dieselben: Im Dünndarm sind die Zotten verkürzt oder fehlen vollständig, und das Oberflächenepithel ist kuboid oder abgeflacht. Lymphgefäße können erweitert sein. Die Mukosa des Dünndarms erscheint infolge der proliferierten Krypten, ebenso wie die des Blinddarms und des Kolons, verdickt. Zu erkennen sind vier bis fünf intensiv angefärbte Epithelzellschichten. Becherzellen sind sehr spärlich oder fehlen vollständig. Die Mitoserate in den Krypten ist erhöht, und in einigen Kryptenlumina sammeln sich Zelltrümmer an (Foto 5.2.1 b). Im Vergleich zu einer gesunden Mukosa (Foto 5.2.1 c) fällt eine gering- bis mittelgradige entzündliche Reaktion in der Lamina propria auf, die sich gelegentlich sogar in tiefere Schichten hinein ausdehnt.
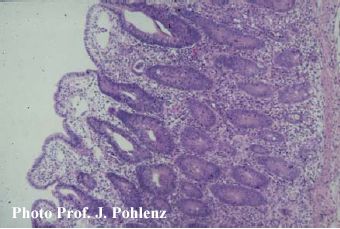
Foto 5.2.1 b: Ileum eines Schweines mit PIA: Verkürzte Darmzotten, bedeckt mit flachen bis kuboiden Epithelzellen, subepitheliales Ödem und proliferierende Krypten. Zu erkennen sind zwei bis drei Schichten von Kryptepithelzellen, ein Verlust der Becherzellen, eine erhöhte Anzahl mitotischer Figuren und intraepithelialer Zellen sowie eine gering- bis mittelgradige entzündliche Reaktion in der Lamina propria (~125x). 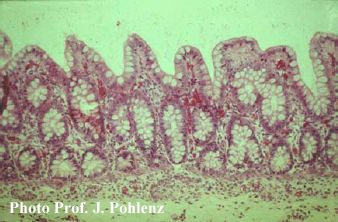
Foto 5.2.1 c: Ileum eines gesunden Mastschweins mit regelmäßiger, physiologischer Zotten- und Kryptepithelstruktur und reichlich Becherzellen (125x). In den weiter fortgeschrittenen Stadien einer hochgradigen, nekroproliferativen Enteritis entwickelt sich eine Verzweigung und eine deutlich sichtbare Unregelmäßigkeit der Krypten mit hochgradiger Nekrose an der Oberfläche (Foto 5.2.1 d). 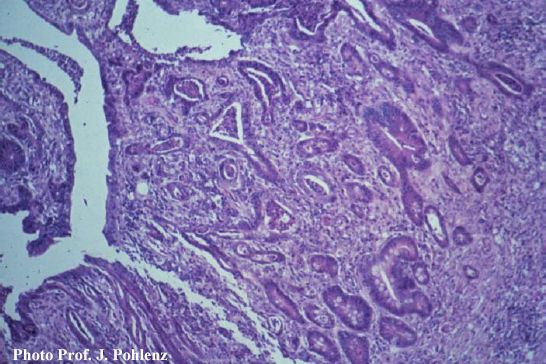
Foto 5.2.1 d: Ileum eines Schweines mit Nekroproliferativer Enteropathie (NE). Unregelmäßig proliferierende, verzweigte, zum Teil mit Zelltrümmern angefüllte Krypten. Nekrose an der Oberfläche (125x). Lawsonia intracellularis kann mit Hilfe der H&E-Färbung nicht nachgewiesen werden. Die IHC macht den intrazellulären Erreger über eine spezifische Reaktion sichtbar. Diese ist in den meisten Fällen an der luminalen Seite der infizierten Kryptepithelzellen zu erkennen und gelegentlich auch in den Makrophagen der Lamina propria nachweisbar (Foto 5.2.1 e). Bei stärkerer Vergrößerung erkennt man vermehrte intraepitheliale Lymphozyten und einige wenige apoptotische Figuren (Foto 5.2.1 f).
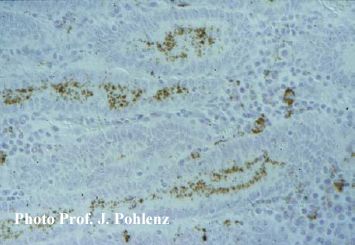
Foto 5.2.1 e: IHC (Immunperoxidase) eines histologischen Schnitts vom Ileum eines Schweines mit Ileitis/PIA: Dunkelbraun angefärbte Bakterien in den Enterozyten der Krypten und in Makrophagen der Lamina propria. (250x). 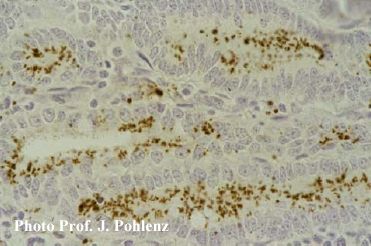
Foto 5.2.1 f: Stärkere Vergrößerung von Foto 5.2.1 e: Lawsonia intracellularis befinden sich überwiegend intrazellulär auf der luminalen Seite der Kryptenterozyten (500x). Diese diagnostisch sehr hilfreiche Darstellung des ursächlichen Erregers wurde erst möglich, seitdem monoklonale Antikörper zur Verfügung stehen. Bei Silberfärbung (Warthin/Starry) färben sich Lawsonien schwarz an. Wie wird die Diagnostik am sinnvollsten eingesetzt? Besteht ein Verdacht auf Ileitis ist das wichtigste Ziel der Diagnostik die Bestimmung des Infektionszeitpunktes, um die notwendigen Maßnahmen zur Kontrolle der Erkrankung zum richtigen Zeitpunkt ergreifen zu können. Aufgrund der bereits erläuterten intermittierenden Ausscheidung von Lawsonia intracellularis lässt sich der Infektionszeitpunkt sehr gut über den Nachweis von Antikörpern (IgG) im Blut bestimmen. Im Rahmen der Diagnostik müssen Proben von Tieren unterschiedlichen Alters innerhalb eines Betriebes gezogen werden, um eine Serokonversion in diesem speziellen Betrieb zu terminieren. Aus dem Zeitpunkt der Serokonversion lässt sich der Infektionszeipunkt (3 Wochen vor Serokonversion) und aus dem Infektionszeitpunkt der optimale Impfzeitpunkt (mindestens 3 Wochen vor Infektion) ableiten.
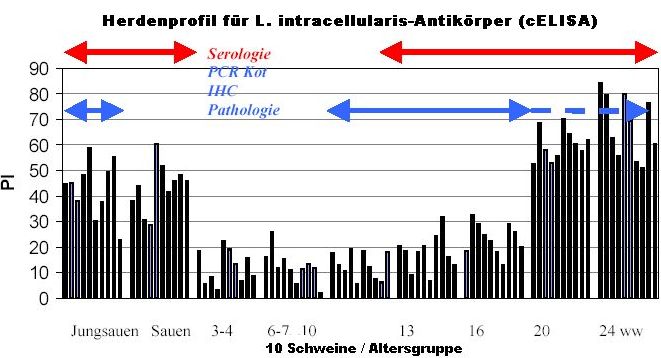
Abb. 5.3 a: Herdenprofil für L. intracellularis-Antikörper (cELISA)
Abbildung 5.3 a zeigt ein serologisches Herdenprofil, das mit Hilfe eines in der Entwicklung befindlichen kompetitiven ELISA (cELISA) für den Nachweis von Antikörpern gegen Lawsonia intracellularis erstellt wurde. In der Regel ist die Serokonversion bei Schweinen im Alter zwischen 16 und 24 Wochen (ww) anhand einer zunehmenden prozentualen Hemmung (PI) nachweisbar. Bei bestimmten Herdenstrukturen und bestimmten betrieblichen Managementverfahren kann die Serokonversion aber auch früher auftreten. In einigen Betrieben werden Jungsauen aus Ställen mit geringem Lawsonia intracellularis-Infektionsdruck remontiert. In diesen Situationen können die naiven oder hochgradig empfänglichen Jungsauen während der Quarantänephase mit dem
Erreger in Kontakt kommen und die akute Form der Erkrankung entwickeln. Die Serologie schafft in diesen Fällen ein stärkeres Bewusstsein für die Erkrankung, die Bestimmung des Infektionszeitpunktes und nicht zuletzt für die Risikokontrolle. Während der Periode der höchsten Antikörperspiegel werden in der Regel Seroprävalenzen von 60 bis 100 % gefunden. Auch wenn die Antikörpertiter anschließend wieder sinken, können sogar noch zum Zeitpunkt der Schlachtung positive Tiere nachgewiesen werden. |
|
audiatur et altera pars |
| Eine Seite der animal-health-online-Gruppe. | © Alle Rechte vorbehalten |