Auf dem Sektionstisch
Pathologisch morphologisch liegen den klinischen Symptomen
der Saugferkelkokzidiose Veränderungen der Dünndarmschleimhaut zugrunde (4). Pathologische Veränderungen können
bei der Sektion am Darm etwa drei bis fünf (5) Tage nach der Infektion mit Oozysten gefunden werden. Da die
Veränderungen abhängig von der Infektionsstärke sind, sind ihre Ausprägungen und Konsequenzen unterschiedlich (3).
Durch die intrazelluläre Entwicklung der verschiedenen Parasitenstadien werden Epithelzellen und ganze
Schleimhautabschnitte zerstört (1-3). Dabei ist vor allem der Dünndarm, insbesondere Jejunum und Ileum (4)
betroffen. Das Darmlumen ist mit einem flüssigen und gelben (6) oder mit einem milchähnlich geronnenen Material (4)
angefüllt. Der Darm erscheint dick und geschwollen (8). Charakteristisch ist eine gelb-graue (9) oder grün-graue
(4) fibro-nekrotische Membran (9), die an der Darmoberfläche anhaften kann (5). Der Darm erscheint verdickt und
strangartig (9). Nach etwa drei Tagen können sich diese Membranen ablösen und als gelb-graues, fibronekrotisches
Material im Darmlumen liegen (5). Die Darmschleimhaut erscheint stumpf und körnig (8). Sie ist stark durchblutet
(Hyperämie) und ödematös (5). Die zugehörigen Darmlymphknoten sind ebenfalls stark durchblutet und ödematös
geschwollen (5). Die auftretende Enteritis wird in der Fachliteratur als katarrhalisch - pseudomembranös (10), in
schweren Fällen nekrotisch (11) oder fibro-nekrotisch (12) beschreiben. Andere Autoren berichten katarrhalische
Veränderungen, petechiale Hämorrhagien (punktförmige Blutungen) und Pseudomembranen als charakteristische Befunde (5).
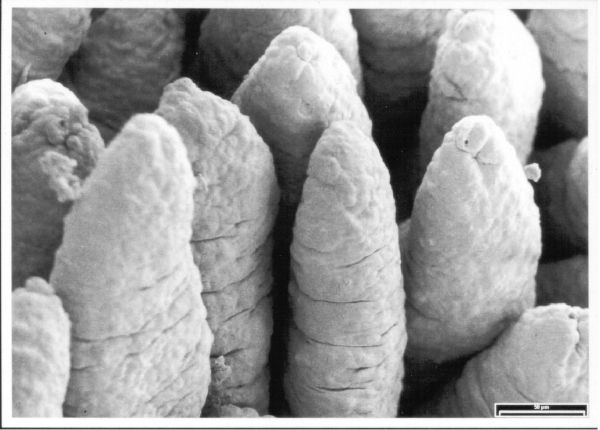
Bild: Gesunde Darmvilli
Unter dem Mikroskop
In den betroffenen Darmabschnitten ist bei der mikroskopischen Untersuchung eine nekrotische Enteritis
festzustellen (12). Typisch ist eine Zottenatrophie (Zottenverkürzung) sowie Zottenfusion (Verschmelzung
der Zotten) (5, 8). Die multifokalen Veränderungen verleihen den Zotten ein stumpfes Aussehen (6, 12)
und führen zu einer Zottenverkürzung (15). An den Zottenspitzen kann es zu Nekrosen (5,10) und Erosionen
kommen (16). In den Krypten herrscht Hyperplasie (7, 8). Das Darmepithel ist multifokal erosiv (7) und
nekrotisch (7, 13) verändert. In der Lamina propria (Bindegewebsschicht unter den Epithelzellen) kommt
es zur Infiltration mit Entzündungszellen und fibrinösem Exsudat (5). Im Darmlumen können nekrotische
Zelltrümmer auftreten (12). In den Darmschleimhautzellen lassen sich im apikalen Bereich in Vakuolen,
die im Zytoplasma basal des Zellkerns liegen und diesen in apikaler Richtung verdrängen, verschiedene
Entwicklungsstadien von Isospora suis finden (5, 8, 10, 13).
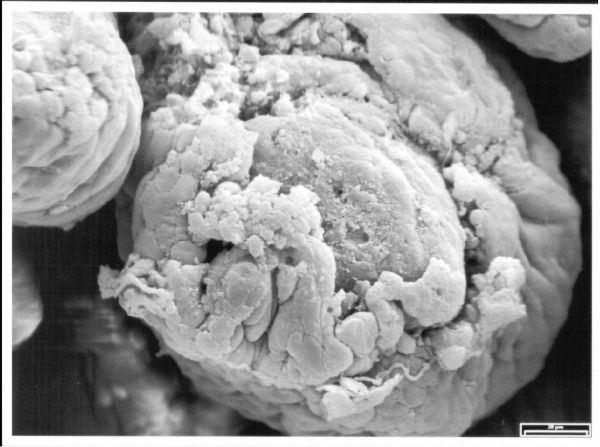
Bild: Geschädigte Villi fünf Tage nach Infektion
Andere Untersucher konnten auch in den
Schleimhautzellen der Krypten Kokzidienstadien nachweisen (14). Ebenso wird sehr oft ein Aufplatzen
der betroffenen Zellen und die Freisetzung der Parasitenstadien beschrieben (17). Parasitenstadien
können auch in den Peyer´schen Platten vorkommen (10). Diese können vergrößert sein (5). Einige
Untersucher konnten in den Gebieten mit ausgedehnten Epithelschäden nur wenig oder keine
Parasitenstadien nachweisen (19). Zumeist sind primär nur die Zotten betroffen.

Bild: Kokzidien auf der Lamina propria
Ausgehend vom
Kryptepithel erfolgt die Regeneration der Schäden, was aber eventuell bei sehr schweren nekrotischen
Veränderungen auch nicht erfolgt (18). Es kann in manchen Bereichen zu vollständiger Desquamation und
Degeneration des Epithels kommen (14), so dass die Schleimhaut wie weggefressen erscheint (8).
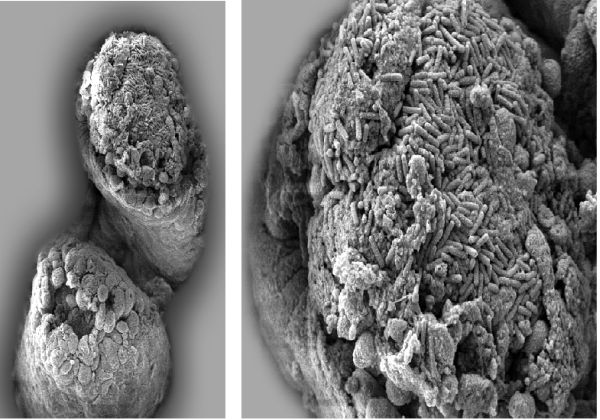
Bild: Darmzotten von Sekundarinfektionen geschädigt
Selbst bei "durchschnittlichen" Infektionsstärken sind die Veränderungen jedoch erheblich.
In der Folge ist die Verdauungsfunktion betroffener Darmabschnitte erheblich gestört, d.h. sowohl die
Verdauung als auch die Nährstoffabsorption sind behindert (unter anderem geringere Bildung von
Verdauungsenzymen, Änderung des Milieus im Darm, kleinere Resorptionsfläche )(3). Durchfall und
schlechtere Gewichtsentwicklung sind die Folge. Die Läsionen begünstigen zudem das Eindringen von
Sekundärerregern, da die Schutzfunktion der Schleimhaut erheblich eingeschränkt ist. Die
Darmschleimhaut regeneriert verhältnismäßig rasch, bereits nach wenigen Tagen ist sie wieder
reepithelialisiert.
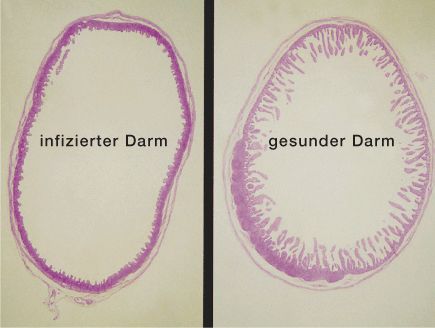
Bild: Dünndarmquerschnitt mit und ohne Kokzidienbefall
Die Verdauungsfunktion ist jedoch auch in dieser Phase noch eingeschränkt, da die
ursprüngliche Zottengröße noch nicht wieder erreicht ist und die neu gebildeten
Epithelzellen auch noch flacher sind. Selbst im Absetzalter sind Unterschiede in der Zottenlänge noch feststellbar.
Literatur:
(1) Meyer, C., A. J Joachim u. A. Daugshies, (1999):
Occurrence of Isospora suis in larger piglet production units and on specialized piglet rearing farms.
Vet. Parasitol. 82, 277-284.
(2) Daugshies, A., C. Meyer u. A. Joachim (1999):
Vorkommen von Isospora suis in Ferkelerzeuger- und Ferkelaufzuchtbetrieben.
Prakt. Tierarzt 6, 530-537.
(3) H.- C. Mundt und A. Daugschies
Die Saugferkelkokzidiose - eine häufige Durchfallerkrankung
Handbuch der tierischen Veredelung, Verlag Kamlage Osnabrück
(4) Larsen K.
Isospora suis. Porcine neonatal coccidiosis.
Veterinaertidsskrift. 1996;79:387- 392.
(5) Vítovec J, Koudela B.
Double alteration of the small intestine in conventional and gnotobiotic piglets
experimentally infected with the coccidium Isospora suis (Apicomplexa, Eimeriidae).
Folia Parasitol. 1990;37:21-33.
(6) Robinson Y, Morin M.
Porcine neonatal coccidiosis in Quebec.
Can Vet J. 1982;23:212-216
(7) Daugschies A, Mundt HC.
Baycox ??- Die neue Möglichkeit zur effektiven Bekämpfung der Kokzidiose des Schweines.
Proc. 4. Int. Bayer-Workshop für Nutztierpraktiker. 2002:44-47
(8) Blagburn BL, Boosinger TR, Powe TA.
Experimental Isospora suis infections in miniature swine.
Vet Parasitol. 1991;38:343-7.
(9) Sangster LT, Stuart BP, Williams DJ, Bedell DM.
Coccidiosis associated with scours in baby pigs.
Vet Med Small Anim Clin. 1978;73:1317-9.
(10) Vítovec J, Koudela B.
Pathology of natural isosporosis in nursing piglets.
Folia Parasitol. 1987;34:199-204.
(11) Higgins RJ.
Diagnosis of Porcine Coccidiosis.
Pig Journal. 1999;43:80-87.
(12) Stuart BP, Gosser HS, Allen CB, Bedell DM.
Coccidiosis in swine: dose and age response to Isospora suis.
Can J Comp Med. 1982;46:317-20.
(13) Stuart BP, Lindsay DS.
Coccidiosis in swine.
Vet Clin North Am Food Anim Pract. 1986;2:455-68.
(14) Harleman JH, Meyer RC.
Life cycle of Isospora suis in gnotobiotic and conventionalised piglets.
Vet Parasitol. 1984;17:27-39.
(15) Cottrell T.
Coccidiosis: A practitioner´s approach.
Compend Contin Educ Pract Vet. 1998;20:S124-9.
(16) Robinson Y, Morin M, Girard C, Higgins R.
Experimental transmission of intestinal coccidiosis to piglets: clinical, parasitological and pathological findings.
Can J Comp Med. 1983;47:401-7.
(17) Coussement W, Ducatelle R, Geeraerts G, Berghen P.
Baby pig diarrhea caused by coccidiosis.
Vet Quarterly. 1981;60:57-104.
(18) Stuart BP, Lindsay DS, Ernst JV, Gosser HS.
Isospora suis enteritis in piglets.
Vet Pathol. 1980;17:84-93.
(19) Niestrath M, Takla M, Joachim A, Daugschies A.
The role of Isospora suis as a pathogen in conventional piglet production in Germany.
J Vet Med B. 2002;49:176-80.
|







