|
PRDC: Metaphylaxe tut Not!
Von Dr. Manfred Stein
Durch die Möglichkeit gegen das PRRS - Virus und Mycoplasmen zu impfen, kann der Schweinehalter bedeutende Faktoren
des PRDC kontrollieren. Da am PRDC (Porcine Respiratory disease Complex) aber auch noch eine ganze Reihe von Bakterien
beteiligt sind, die nicht durch Impfstoffe abgedeckt werden bzw. diese Impfungen nicht sinnvoll in die Aufzuchtphase
integriert werden können, wird auch weiterhin der Einsatz von Antibiotika notwendig sein.
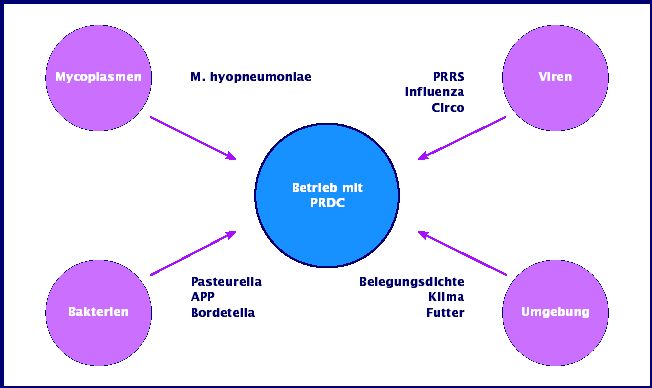
PRDC: drei Brennpunkte
Oft handelt es sich beim PRDC um Probleme, die mit einer gewissen Regelmäßigkeit im Bestand wiederkehren. Der PRDC tritt bei:
abgesetzten Ferkel
bei Vormasttieren
und in der Endmast (über 50 kg KGW)
auf.
Gezielt
Vorraussetzung für eine gezielte Metaphylaxe ist die Kenntnis der beteiligten Erreger aus vorhergegangenen Krankheitsverläufen,
dem Einsatz eines Antibiotikums, welches ein weites Keimspektrum abdeckt und der frühzeitige Einsatz des Antibiotikums. Bei
wechselnden Ferkelherkünften sind Informationen aus vorhergehenden Mastdurchgängen wenig aussagefähig. Hier können kurzfristig
narkotisierte Ferkel mit Hilfe der brochoalveolären Lavage (BAL) untersucht werden, um einen Überblick über die aktuell im Bestand
vorkommenden Erreger zu erhalten (15, 16). Durch die Narkose werden die Tiere wenig gestresst, die Untersuchung durchführbar und
es bleibt der wert des Tieres erhalten.
Grundsätzlich sollte das gewählte Fertigarzneimittel zur Metaphylaxe von Pneumonien beim Schwein zugelassen sein. Gleichzeitig
muss sich das Antibiotikum gezielt in der Lunge und in den oberen Atemwegen anreichen und dort die minimalen Hemmkonzentrationen
der beteiligten Erreger deutlich übersteigen.
Eine außergewöhnliche Eigenschaft der Antibiotikums Tilmicosin (Pulmotil®) macht die Substanz besonders geeignet zur Metaphylaxe
des PRCD. Bekanntlich vermehren sich die am PRDC maßgeblich beteiligten PRRS-Viren ähnlich wie Circo-Viren (PCV 2) in Makrophagen
der Lunge und zerstören diese hierbei (9 -11). Trotz Impfung des Sauenbestandes und der Ferkel können insbesondere zu Beginn einer
PRRS-Impfkampangne noch PRRS-Viren unter den Absatzferkeln zirkulieren und so in die Mast gelangen. Wie mehrere Studien belegen,
scheint Tilmicosin die Vermehrung des PRRS-Virus in Makrophagen zu verlangsamen. Es wird diskutiert, dass durch die Anreicherung
der Antibiotikums Tilmicosin in den Makrophagen (1, 21, 12, 13, 17) der intrazelluläre pH-Wert in diesen Immunzellen steigt und so
Einfluss auf die Virusvermehrung genommen wird (2, 6, 8). Das Antibiotikum Tilmicosin kann so ein PRRS-Impfprogramm sinnvoll
ergänzen.

Für das Antibiotikum ist einer Wirksamkeit bei Actinobacillus pleuropneumoniae (3, 7, 18, 20), Pasteurellen, Haemophilus parasuis
(14,19) und Mycoplasmen (4) belegt. Tilmicosin verhindert die Anheftung von Mycoplasmen an die Zilien der Atemwegsschleimhäute (4).
Diese Effekte werden durch die Anreicherung von Tilmicosin in den Schleimhäuten der Atemwege, in der Lunge und in den Makrophagen
begünstigt (22, 24, 17), so dass minimale Hemmkonzentrationen empfindlicher Erreger in der Lunge über mehrere Tage überschritten
werden (17).

Haemophilus parasuis (Glässer): Fibrinöse Pleuritis als typisches Symptom
Dosierung
Gewöhnlich wird Tilmicosin als Pulver zur oralen Verabreichung oder als Arzneimittelvormischung (Pulmotil®) in einer Dosierung von 2 kg pro
Tonne Futter über 21 Tage eingesetzt. Eine Trinkwassermedikation mit einer Lösung ist möglich.

Literatur
(1) Scorneaux, B. and Shryock, T.R. 1998,
Intracellular accumulation, subcellular distribution and efflux of tilmicosin in swine phagocytes,
JVPT (Journal of Veterinary Pharmacology & Therapeutics) 21(4):257-268.
(2) Fraile, L., C. Rosell, S. Lapuente
Reduction of PRRSV and Respiratory clinical disease by tilmicosin
Proceedings of the 18th IPVS Congress, Hamburg, Germany, 2004 - Volume 1 P. 38
(3) Marie-Anne Paradis, Gordon H. Vessie, John K. Merrill, C. Paul Dick, Camille Moore, George Charbonneau,
M. Gottschalk, Janet I. MacInnes, Robert Higgins, K.R. Mittal, C. Girard, Jeffery J. Aramini, Jeffrey B. Wilson
Efficacy of tilmicosin in the control of experimentally induced Actinobacillus pleuropneumoniae infection in swine
Canadian Journal of Veterinary Research January 2004, Vol. 68 No. 1, p: 7 - 12
(4) Thacker, E., Young, T.F., Erickson, B.Z. DeBey, M.C. (2001).
Evaluation of the ability of tilmicosin to prevent adherence of Mycoplasma hyopneumoniae to Cilia using a
differentiated swine respiratory epithelial culture system
Veterinary Therapeutics 2(4): 293-300.
(5) Fossler, S., JW Moran, TD Thomson.
Pulmotil mode of action against Mycoplasma hyopneumoniae in swine
Proceedings, 17th IPVS Congress., 2002.
(6) Molitor, T.W., Bautista, E., Shin, J., McGruder, E., Armbuster, G.A., 2001,
Tilmicosin affects Porcine Reproductive and Respiratory syndrome virus replication.
Allen D. Leman Swine Conference, 28 (suppl), 31.
(7) Hoflack G.; Maes D.; Mateusen B.; Verdonck M.; De Kruif A.
Efficacy of Tilmicosin Phosphate (Pulmotil® Premix) in Feed for the Treatment of a Clinical Outbreak of
Actinobacillus pleuropneumoniae Infection in Growing-Finishing Pigs
Journal of Veterinary Medicine, Series B, November 2001, Vol. 48, No. 9, p: 655-664
(8) Benfield, David A.
An evaluation of the effects of tilmicosin in feed on nursery pigs inoculated with porcine reproductive and respiratory syndrome virus
Proceedings of the 33rd annual meeting of the American Association of Swine Veterinarians, Kansas City, 2002 p: 87 - 91
(9) Lawson SR, Rossow KD, Collins JE, Benfield DA, Rowland RR
Porcine reproductive and respiratory syndrome virus infection of gnotobiotic pigs: sites of virus replication and
co- localization with MAC-387 staining at 21 days post-infection.
Virus Research. 1997;51:105-13.
(10) Pol J, Wagenaar F, Broekhuijsen-Davies J, Wensvoort G.
The morphogenesis of Lelystad virus in porcine lung alveolar macrophages.
Proc Congr Int Pig Vet Soc. 1992;12:127.
(11) Wensvoort G, Terpstra C, Pol JMA, ter Lack EA, Bloemaraad M, de Kluyver EP, Kragten C,van Buiten L, den Besten A,
Wagenaar F, Broekhuijsen JM, Moonen PLJM, Zestra T, de Boer EA, Tibben HJ, de Jong MF, van'' Veld P,
Groenland GJR, van Gennep JA, Voets MTh, Verheijen JHM, Braamskamp J.
Mystery swine disease in the Netherlands: isolation of Lelystad virus.
Vet Quarterly. 1991;3:121-130.
(12) Scorneaux, B. and T. R. Shryock
Intracellular accumulation, subcellular distribution, and efflux of tilmicosin in bovine mammary, blood, and lung cells
Journal of Dairy Science, 1999, Vol 82, Issue 6 pp: 1202-1212
(13) Scorneaux, B. and T. R. Shryock
Intracellular Accumulation, Subcellular Distribution, and Efflux of Tilmicosin in Chicken Phagocytes
1998 Poultry Science 77:1510-1521
(14) Paradis, M.A; G.H. Vessie,; C.P. Dick,; J.I. MacInnes, ; L. Slavic, ; S. Watson, ; J.B. Wilson,
Efficacy of tilmicosin in the management of experimentally induced Haemophilus parasuis infection in swine
Proceedings of the 33rd annual meeting of the American Association of Swine Veterinarians, Kansas City, 2002; p: 129 - 131
(15) Mombarg,M. J., Niewold,T. A., Stockhofe-Zurwieden,N., Leengoed,L. A. M. G., Verheijden, J. H. M.
Assessment of Respiratory Herd Health in Weaner Pigs by Measuring Cellular Composition of Bronchoalveolar Lavage Fluid
2002, J Vet Med Series B, 49:9, p. 424-428
(16) HARTWIG, W. (1994):
Die Eignung der Bronchoskopie und der brochoalveolären Lavage (BAL) für die epidemiologische Untersuchung respiratorischer
Erkrankungen im Schweinebestand
Dissertation an der Außenstelle der Tierärztlichen Hochschule Hannover
(17) Kluge, Katharina; F. R. Ungemach
Neue Arzneimittel für Pferde und landwirtschaftliche Nutztiere und Veränderungen auf dem Arzneimittelmarkt seit 1996
Tierärztl Prax 1998; 26 (G): 301 - 306
(18) Binder, S.; Le, N.B.; Berner, H.; Bauer, J.:
Zur Wirksamkeit von Tilmicosin bei respiratorischen Erkrankungen des Schweines.
Berl. u. Münch. tierärztl. Wschr. 106 (1993) S. 6-9.
(19) Aarestrup FM, Seyfarth AM, Angen O.
Antimicrobial susceptibility of Haemophilus parasuis and Histophilus somni from pigs and cattle in Denmark.
Vet Microbiol. 2004 Jun 21;101(2) p.143-6.
(20) Hoflack G, Maes D, Mateusen B, Verdonck M, de Kruif A.
Efficacy of tilmicosin phosphate (Pulmotil premix) in feed for the treatment of a clinical outbreak of Actinobacillus
pleuropneumoniae infection in growing-finishing pigs.
J Vet Med B Infect Dis Vet Public Health. 2001 Nov;48(9):655-64.
(21) Blais J, Chamberland S. Intracellular accumulation of tilmicosin in primary swine alveolar macrophages.
Proceedings of the 13th IPVS Congress, Bangkok, Thailand, June 26-30, 1994. p. 331. (non-refereed)
(22) Jackman, R, Spencer YI, Silverlight JJ, Marsh SA, Bellerby PJ.
Development of antibodies to tilmicosin and their use in the immunolocalization of the antibiotic in porcine lung tissue.
J Vet Pharmacol Therap. 1997; 20 (Suppl 1): 131.
(24) Thomson, TD, Darby JM, Moran JW, Tonkinson LV.
Serum and lung tilmicosin concentration in swine following dosing with tilmicosin fortified feed.
Proceedings of the 13th IPVS Congress, Bangkok, Thailand, June 26-30, 1994. p. 330. (non-refereed)
|
Copyright by animal-health-online
|








