|
Ileitis Monitor |
 |
| Onlinemagazin zur Ileitis des Schweines | ... online seit 2003 | |
von Dr. Manfred Stein, 22.08.2004
|
Unter Verwendung von wissenschaftlichem Material von Dr. Steve McOrist, Dr. Torsten Hardge, Dr. Volker Ohlinger, Prof. Dr. Joachim Pohlenz, Harm Voets DVM, Don Walter DVM. Wie infiziert Lawsonia intracellularis die Darmzelle?
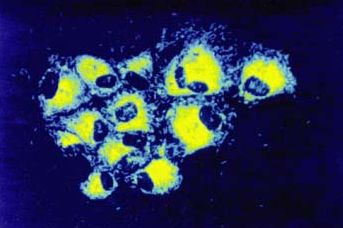
Es muss also offenbar eine komplexe physiologische Darmflora vorhanden sein, damit sich eine intrazelluläre Lawsonieninfektion und die damit assoziierte Erkrankung entwickeln können. Bis heute ist über die Abläufe innerhalb der ersten 5 Tage post infectionem wenig bekannt. Vermutet wird, dass die Anwesenheit einer bestimmten Darmflora die Pathogenität von Lawsonia intracellularis beeinflusst, indem sie das Oxidations-Reduktionspotenzial im Darm oder die Teilungsrate der Enterozyten modifiziert. Zehn Tage post infectionem haben sich die Lawsonien deutlich vermehrt und befinden sich innerhalb der Kryptepithelzellen der Darmzotten. Dort rufen die Erreger eine hyperplastische Reaktion hervor, die offenbar mit der Zunahme intrazellulärer Bakterien im Zusammenhang steht. Die Rückbildung dieser pathologischen Veränderungen ist eng verknüpft mit der Reduktion der Anzahl intrazellulärer Bakterien. In einem Review beschreibt McOrist (1994) einen möglichen Mechanismus, über den der Erreger diese Veränderungen induziert. Die proliferierenden Enterozyten zeigen eine schwache Expression von MHC-Klasse II-Molekülen, was möglicherweise eine Unterdrückung der Immunantwort zur Folge hat. Das so entstehende Defizit infizierter Enterozyten, Antigen zu präsentieren, kann schließlich eine Art geschützte Nische für Wachstum und Teilung von Lawsonia intracellularis darstellen. Die Ausbreitung von Lawsonia intracellularis innerhalb des Darms erfolgt hauptsächlich durch infizierte Zellen. Der Erreger dringt zunächst in die Kryptepithelzellen ein und teilt sich intrazellulär. Die infizierten Kryptepithelzellen schieben sich schließlich nach dem Muster der physiologischen Epithelerneuerung zur Epitheloberfläche. Die Abstoßung infizierter Zellen aus dem Epithelzellverband führt dann zu einer Kolonisierung der distal der Primärläsion gelegenen Darmabschnitte und mündet letztlich auch in der Ausscheidung des Erregers über den Kot. Da Hochgradigkeit und Konfluenz der Läsionen nach distal zunehmen, scheint sich die Infektion von den oberen Darmabschnitten aus absteigend in Richtung der unteren Darmabschnitte zu entwickeln. Der Prozess des Zelleintritts der Erreger ist abhängig von der Zellaktivität. Bei Anwesenheit spezifischer Antikörper ist die Aufnahme des Erregers in die Zellen vermindert. Deshalb wirken Medikamente, die das Zellwachstum hemmen, gleichzeitig auch der intrazellulären Multiplikation des Erregers entgegen. Infizierte Darmzellen behalten ihre Teilungsfähigkeit auch bei sehr starkem Befall mit Lawsonien. Dies hat zur Folge, dass bereits zwischen Tag 2 und Tag 6 nach der Inokulation des Erregers mehr als 90 % der Zellen infiziert sein können. Das Ausmaß der Infektion hängt entscheidend von der Anzahl der Bakterien im Inokulum ab. Mischinfektionen mit Lawsonia intracellularis und anderen darmpathogenen Erregern werden beschrieben. Man
vermutet, dass der eine oder andere pathogene Erreger die Immunantwort modifiziert und somit eine Prädisposition
für eine Mischinfektion schaffen. Der Verlust von Becherzellen und das dadurch bedingte Fehlen der mechanischen
Schleimbarriere an der Schleimhautoberfläche, also einer der ersten Verteidigungslinien des Darms, tragen zu
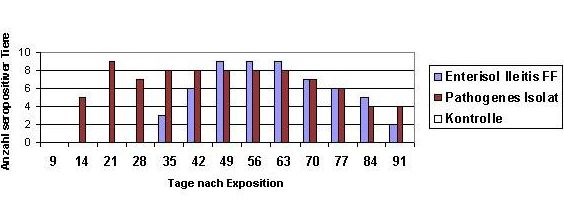
einer erhöhten Infektionsanfälligkeit bei. Bei der akuten Form der Porzinen Proliferativen Enteropathie entwickelt sich eine akute entzündliche Reaktion in der Lamina propria und in der Submukosa. Makrophagen werden entlang freier Lawsonia intracellularis-Bakterien im apikalen Zytoplasma gefunden. Bei der unkomplizierten Form der Ileitis kommt es zu einer Rückbildung der Infektion und zur Clearance der Bakterien in dem Maße, in dem die Hyperplasie zurückgeht. Gesunde Zellen regenerieren sich aus den Krypten heraus, vermehren sich und bauen allmählich wieder eine physiologische Zottenstruktur auf. Darüber hinaus ist diese Regeneration gekennzeichnet durch eine Degeneration von Epithelzellen, Apoptose von Makrophagen und die Neubildung von Becherzellen. Liegt die Infektion einige Wochen zurück, sind zum Zeitpunkt der Schlachtung unter Umständen keinerlei makroskopische Befunde mehr nachweisbar. Werden bei der Schlachtung also keine Läsionen im Darm gefunden, so bedeutet dies nicht, dass keine Ileitis vorgelegen hat. Jüngste Forschungsergebnisse zeigen, dass makroskopische und mikroskopische Befunde, sowie positive PCR- und IgA-Tests im Darm nur zwischen 11 und 35 Tagen nach einer experimentellen Infektion mit Lawsonia intracellularis nachweisbar sind. Die Reaktion des Immunsystems auf eine Infektion durch Lawsonia intracellularis Über die humorale und die zellvermittelte Immunantwort bei Schweinen nach einer Lawsonia intracellularis-Exposition ist nur wenig bekannt. Serum-IgG wird routinemäßig mit Hilfe von IFA oder IPMA nachgewiesen. Meist setzt die Serokonversion zwei Wochen nach der Infektion ein. In Anbetracht der Tatsache, dass es sich bei Lawsonia intracellularis um einen obligat intrazellulären Erreger im Darmepithel handelt, ist es sehr unwahrscheinlich, dass Serum-IgG wirksam gegen die Infektion schützen kann. Eine sehr viel wichtigere immunologische Rolle dürften dagegen sekretorisches IgA und zellvermittelte Immunreaktionen spielen. Dennoch spiegelt der Nachweis von IgG im Serum den Beginn einer immunologischen Reaktion des Organismus gegen den Erreger wider. Der Beginn der Serokonversion ist letztlich abhängig von der Infektionsdosis im Inokulum. Abbildung: Einleitung der Serokonversion nach Infektion durch Lawsonia intracellularis
IPMA-Ergebnisse für Serum-IgG gegen Lawsonia intracellularis bei Schweinen. Guedes and Gebhart / Vet. Microb. 91 (2003) 135-145 Die Ergebnisse europäischer Impfstudien mit Enterisol® Ileitis zeigen eine geringgradige Reaktion im IFA und IPMA auf Serum-IgG. Die zellvermittelte Immunantwort ist ein wichtiger Abwehrmechanismus des Körpers gegen Infektionen durch intrazelluläre Erreger. Die Evaluierung zellvermittelter Immunreaktionen erfolgt mit Hilfe des ELISPOT-Assays, der die Sekretion von gamma-Interferon (IFN-Y) durch Memory-T-Zellen oder aktivierte T-Lymphozyten nachweist. Jüngste Studien von Guedes und Gebhart (2003) sowie von MacIntyre, Smith, Shaw, Thomson und Rhind (2003) bringen etwas mehr Licht in die zellulären Immunreaktionen im Zusammenhang mit Lawsonia intracellularis-Infektionen. Abbildung: Immunantwort auf eine Belastungsinfektion durch Lawsonia intracellularis 
Frei nach: MacIntyre, Smith, Shaw, Thomson und Rhind / Vet. Path. 40:4 (2003) Die Autoren schlossen aus ihren Ergebnissen, dass eine Unterdrückung der T-Zellen, insbesondere der CD3+ und CD8+ Zellen im Zottenepithel, die Unfähigkeit des Wirts widerspiegelt, eine zelluläre Antwort auf das intrazelluläre Pathogen Lawsonia intracellularis aufzubauen. Dies führte zur Hypothese einer mit der Erkrankung assoziierten Downregulation intraepithelialer Lymphozyten. In hyperplastisch veränderten Krypten wurde eine größere Anzahl Makrophagen gefunden als in zwar infizierten, aber nicht hyperplastischen Krypten. Diese massive Infiltration durch aktivierte Makrophagen, die ihren Peak an Tag 14 erreicht, könnte der Schlüsselfaktor für die Entwicklung der hämorrhagischen Form der Erkrankung sein. Die Abnahme der B-Zellen ist in Anbetracht der nachweisbaren Akkumulation von IgA in den Enterozyten ein eher unerwarteter Befund. Es handelt sich hierbei um ein Phänomen, dass auch von anderen Autoren beobachtet wird, eine Erklärung hierfür gibt es bisher nicht. Es bleibt festzuhalten, dass die Antwort des Immunsystems auf eine intrazelluläre Infektion, zum Beispiel durch Lawsonia intracellularis, bis heute nicht ausreichend geklärt ist und einer der zentralen Forschungsbereiche in der Zukunft sein dürfte. |
|
audiatur et altera pars |
| Eine Seite der animal-health-online-Gruppe. | © Alle Rechte vorbehalten |